- SUPERCONDUCTEURS IONIQUES
- SUPERCONDUCTEURS IONIQUESLa matière peut prendre différents états (plasma, gaz, liquide, solide) qui se différencient par leur densité, leur capacité thermique massique et, en particulier, la valeur du coefficient de diffusion des espèces constituantes: atomes, ions, molécules. Les mouvements de ces espèces sont très rapides dans un gaz, beaucoup plus lents dans un liquide, faibles et rares dans un solide où atomes, ions ou molécules occupent une position moyenne bien définie.Cependant, dans certains solides ioniques, des espèces ont un coefficient de diffusion comparable à ceux que l’on trouve dans les liquides; des propriétés électriques remarquables en résultent: dans un composé ionique, les porteurs de charges étant les ions eux-mêmes, la conductivité sera proportionnelle à leur coefficient de diffusion. Ces matériaux, aussi bons conducteurs que les électrolytes liquides usuels, sont appelés superconducteurs ioniques ou conducteurs ioniques rapides (tabl. 1).La mise en évidence de ces propriétés est ancienne: dès 1914, C. Tuband et E. Lorenz déterminèrent la conductivité de l’iodure d’argent 見. Par contre, le développement d’études scientifiques et technologiques sur ces conducteurs ne commença que vers les années soixante avec la recherche de matériaux pour le stockage et la production d’énergie. En 1968, le dépôt d’un brevet par deux chercheurs de la Ford Motor Company, J. T. Kummer et N. Weber, sur l’emploi de l’aluminate de sodium 廓, dite alumine 廓, comme électrolyte solide dans un accumulateur utilisant le couple sodium/soufre marqua le départ d’une compétition entre différents laboratoires universitaires et industriels (General Electric, Ford, Bell Telephone, BrownBoveri, Compagnie générale d’électricité). Une nouvelle impulsion fut donnée en 1978 avec les recherches de bons conducteurs protoniques pour les systèmes de stockage d’énergie utilisant l’hydrogène, et, plus tard, avec le développement de la microionique (c’est-à-dire l’utilisation des techniques de la microélectronique pour la réalisation de dispositifs électrochimiques miniaturisés: piles, capteurs, supercondensateurs ou afficheurs...). On peut alors réaliser des dispositifs où la couche d’électrolyte a une épaisseur variant entre 200 nm et 100 猪m.L’intérêt des superconducteurs ioniques comme électrolytes est dû aux caractéristiques suivantes:– matériaux solides, ils peuvent être élaborés sous forme de céramique, en couches minces, et permettent de réaliser des systèmes électrochimiques dont tous les composants sont solides;– leur conductivité élevée est purement ionique; l’absence de conductivité électronique évite une décharge des piles par court-circuit interne;– il est possible d’employer des électrodes liquides, ce qui simplifie les problèmes d’interfaces; la polarisation d’électrodes est diminuée;– leur grande stabilité chimique et thermique permet d’utiliser des couples électrochimiques à haute densité d’énergie massique ou volumique (sodium/ soufre, lithiumluor, etc.) et de fabriquer des piles à combustible fonctionnant à haute température, qui n’impliquent pas l’utilisation de métaux précieux aux électrodes.Aujourd’hui, le stockage de l’énergie sous forme électrique ou chimique est économiquement réalisable: grâce à la construction de centrales de stockage de l’électricité par accumulateurs sodium/aluminate de sodium 廓/polysulfures de sodium, on peut éviter les gigantesques pannes que connurent New York en 1977, ou la France en 1978 et 1985.1. De la conductivité à la superconductivité ioniqueLa conductivité 靖 d’un solide non métallique est la somme de deux contributions, l’une électronique ( 靖e ), l’autre ionique ( 靖i ):
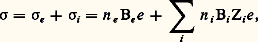 où n e , Be et e représentent respectivement le nombre de porteurs de charges électroniques (électrons ou trous), leur mobilité et leur charge, n i , Bi et Zi e , le nombre de porteurs de charges ioniques, leur mobilité et leur charge; i varie avec le nombre d’espèces ioniques diffusantes. Les conducteurs ioniques sont des composés qui présentent une conductivité électrique assurée uniquement par le mouvement d’ions par opposition aux composés où les porteurs de charges sont exclusivement des électrons.Dans un solide, chaque atome vibre autour d’une position d’équilibre (site), mais à tout instant quelques atomes changent de position d’équilibre; un déplacement permanent de matière en résulte: c’est la diffusion, qui se produit quand existent des écarts par rapport à la structure idéale moyenne (défauts), par exemple si un atome ou un ion dans un cristal ionique, une molécule dans un cristal moléculaire, a dans son environnement un site libre, ou si cet atome occupe une position irrégulière (interstitielle).On décrit le processus de diffusion comme le saut discret d’une particule par-dessus une barrière de potentiel: dans l’état d’équilibre, l’ion effectue des oscillations harmoniques au fond du puits de potentiel et approche la barrière avec une fréquence 益0 en ayant une certaine probabilité de la franchir; les particules sont réparties dans différents états énergétiques suivant une loi exponentielle (statistique de Boltzmann), les états les plus stables étant les plus peuplés. Un saut par-dessus la barrière convertit une oscillation en un mouvement de translation de longueur d . La probabilité W de saut par unité de temps est égale au produit du nombre de fois 益0 que la particule approche la barrière par la probabilité de la franchir:
où n e , Be et e représentent respectivement le nombre de porteurs de charges électroniques (électrons ou trous), leur mobilité et leur charge, n i , Bi et Zi e , le nombre de porteurs de charges ioniques, leur mobilité et leur charge; i varie avec le nombre d’espèces ioniques diffusantes. Les conducteurs ioniques sont des composés qui présentent une conductivité électrique assurée uniquement par le mouvement d’ions par opposition aux composés où les porteurs de charges sont exclusivement des électrons.Dans un solide, chaque atome vibre autour d’une position d’équilibre (site), mais à tout instant quelques atomes changent de position d’équilibre; un déplacement permanent de matière en résulte: c’est la diffusion, qui se produit quand existent des écarts par rapport à la structure idéale moyenne (défauts), par exemple si un atome ou un ion dans un cristal ionique, une molécule dans un cristal moléculaire, a dans son environnement un site libre, ou si cet atome occupe une position irrégulière (interstitielle).On décrit le processus de diffusion comme le saut discret d’une particule par-dessus une barrière de potentiel: dans l’état d’équilibre, l’ion effectue des oscillations harmoniques au fond du puits de potentiel et approche la barrière avec une fréquence 益0 en ayant une certaine probabilité de la franchir; les particules sont réparties dans différents états énergétiques suivant une loi exponentielle (statistique de Boltzmann), les états les plus stables étant les plus peuplés. Un saut par-dessus la barrière convertit une oscillation en un mouvement de translation de longueur d . La probabilité W de saut par unité de temps est égale au produit du nombre de fois 益0 que la particule approche la barrière par la probabilité de la franchir: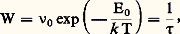 où k est la constante de Boltzmann et où E0, l’énergie d’activation, représente la hauteur de la barrière; la probabilité W est égale à l’inverse de 精, temps de vie de la particule diffusante ou temps de vol entre deux sites. La fréquence 益0 est de l’ordre de 1012 à 1013 s -1, ce qui correspond au domaine infrarouge. La valeur de E0 est de l’ordre de plusieurs électrons-volts dans un composé ionique à structure compacte.On peut relier cette description à l’échelle atomique au modèle macroscopique de la diffusion (lois de Fick); le flux de matière diffusant est proportionnel au gradient de concentration, comme le flux de chaleur est proportionnel au gradient de température (loi de Fourier):
où k est la constante de Boltzmann et où E0, l’énergie d’activation, représente la hauteur de la barrière; la probabilité W est égale à l’inverse de 精, temps de vie de la particule diffusante ou temps de vol entre deux sites. La fréquence 益0 est de l’ordre de 1012 à 1013 s -1, ce qui correspond au domaine infrarouge. La valeur de E0 est de l’ordre de plusieurs électrons-volts dans un composé ionique à structure compacte.On peut relier cette description à l’échelle atomique au modèle macroscopique de la diffusion (lois de Fick); le flux de matière diffusant est proportionnel au gradient de concentration, comme le flux de chaleur est proportionnel au gradient de température (loi de Fourier):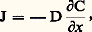 où J est le flux de matière traversant l’unité de surface par unité de temps dans la direction x et C la concentration de l’espèce diffusante; le coefficient de proportionnalitéD est appelé coefficient de diffusion. Cette expression est modifiée en présence d’une force extérieure (créée par exemple par un champ électrique) avec l’apparition d’un terme d’entraînement proportionnel à la concentration.Le coefficient de diffusion est proportionnel à la fréquence de saut 益; pour s directions de saut équiprobables, on aura:
où J est le flux de matière traversant l’unité de surface par unité de temps dans la direction x et C la concentration de l’espèce diffusante; le coefficient de proportionnalitéD est appelé coefficient de diffusion. Cette expression est modifiée en présence d’une force extérieure (créée par exemple par un champ électrique) avec l’apparition d’un terme d’entraînement proportionnel à la concentration.Le coefficient de diffusion est proportionnel à la fréquence de saut 益; pour s directions de saut équiprobables, on aura: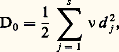 où d j représente la longueur du saut. En fait, la structure du matériau et le type de défaut favorisent certains sauts, et cela conduit à introduire un facteur de corrélation f ; de plus, la fréquence 益 varie avec la température, d’où :
où d j représente la longueur du saut. En fait, la structure du matériau et le type de défaut favorisent certains sauts, et cela conduit à introduire un facteur de corrélation f ; de plus, la fréquence 益 varie avec la température, d’où :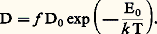 Quand le matériau est soumis à un champ électrique, le courant est égal au produit du flux d’ions par la charge de ces derniers et la conductivité est:
Quand le matériau est soumis à un champ électrique, le courant est égal au produit du flux d’ions par la charge de ces derniers et la conductivité est: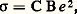 où C est la concentration d’ions diffusants, B la mobilité des ions et e leur charge. La loi de Nernst-Einstein relie coefficient de diffusion et conductivité:
où C est la concentration d’ions diffusants, B la mobilité des ions et e leur charge. La loi de Nernst-Einstein relie coefficient de diffusion et conductivité: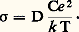 En général, la concentration d’espèces conductrices C varie avec la température:
En général, la concentration d’espèces conductrices C varie avec la température: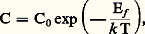 où Ef représente l’énergie de création du défaut; par exemple, pour un défaut de type Frenkel (un ion quitte son site pour occuper un site interstitiel en laissant une lacune), cette énergie est de l’ordre de 3 eV dans un halogénure alcalin, ce qui correspond à une concentration de défauts C/C0 de 10-19 à 100 0C ou de 10-5 à 1 500 0C.La conductivité 靖 est proportionnelle à:
où Ef représente l’énergie de création du défaut; par exemple, pour un défaut de type Frenkel (un ion quitte son site pour occuper un site interstitiel en laissant une lacune), cette énergie est de l’ordre de 3 eV dans un halogénure alcalin, ce qui correspond à une concentration de défauts C/C0 de 10-19 à 100 0C ou de 10-5 à 1 500 0C.La conductivité 靖 est proportionnelle à: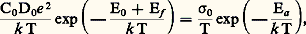 où 靖0 est le terme pré-exponentiel et E0 + Ef = Ea l’énergie d’activation. Le terme pré-exponentiel 靖0 dépend de la structure du matériau, tout comme l’énergie d’activation qui représente la somme de l’énergie nécessaire à la création du défaut, Ef , et de l’énergie nécessaire à sa diffusion, E0. Si l’on porte lg 靖T en fonction de 1/T, on obtient une droite dont la pente est proportionnelle à l’énergie d’activation. Pour les conducteurs ioniques (halogénures alcalins, oxydes, etc.), cette droite présente plusieurs ruptures de pente:– aux températures élevées, le comportement est dit intrinsèque; la concentration de défauts créés par l’agitation thermique est largement supérieure à celle des défauts dus aux impuretés; Eia représente la somme de l’énergie de formation et de celle de la migration du défaut;– quand la température diminue, un moment vient où la concentration en impuretés (ou dopant) fixe le nombre de porteurs de charges; ce domaine est dit extrinsèque et Ea ex représente seulement l’énergie de migration du défaut dû à l’impureté, toujours inférieure à Eia ;– à basse température, un domaine existe où la conductivité est réglée par des associations de défauts (formation de paires, par exemple); la pente est de nouveau forte car Ea est la somme des énergies d’association et de migration du défaut.Certains défauts ou impuretés peuvent provoquer une conductivité électronique.Un superconducteur ionique sera caractérisé par une conductivité ionique élevée et une énergie d’activation très faible, typiquement de 0,1 à 0,2 eV, ce qui représente moins de 10 p. 100 de l’énergie de formation d’un défaut ponctuel dans un cristal ionique et reflète les particularités structurales de cette classe de matériaux. Le nombre d’espèces conductrices est important et quasi indépendant de la température. Il existe de larges zones de défauts où, pour les ions conducteurs, le rapport entre sites disponibles et sites occupés est voisin de 1. La concentration de défauts est indépendante de la température.La figure 1 présente la variation de la conductivité en fonction de la température pour différents conducteurs ioniques; les valeurs de la conductivité et de l’énergie d’activation pour différents superconducteurs ioniques sont données dans le tableau 2.Liquide et superconducteur ioniqueUn champ électrique est statique ( 諸 = 0) ou alternatif; sa fréquence varie dans un très large domaine: depuis la lumière (infrarouge: 1013 Hz) jusqu’aux basses fréquences (50 Hz) en passant par les micro-ondes (109 Hz) et les ondes radio. La conductivité est fonction de la fréquence: 靖( 諸) = 諸 練 﨎0 練 﨎 ( 諸), où 﨎0 est la permitivité du vide et 﨎 ( 諸) la partie imaginaire de la constante diélectrique.Si la conductivité est à l’origine des applications des superconducteurs ioniques, elle est aussi un moyen d’étude puissant qui permet de relier les propriétés atomiques à celles que l’on peut observer macroscopiquement: quand la fréquence augmente, la distance du transport de matière observé diminue.En association avec d’autres méthodes comme la diffusion de neutrons, on a pu caractériser le mouvement des particules dans l’espace et dans le temps en déterminant les fonctions de corrélation et connaître le temps de résidence de l’espèce diffusive au fond de son puits de potentiel et son temps de vol entre deux puits. Selon les composés, trois grands types de mécanismes de diffusion existent:– dans un solide ionique, le temps de vol 精1 est court devant le temps de résidence 精0;– dans un superconducteur ionique (AgI 見, Na+ 廓Al23, Ag+ 廓Al23), le temps de résidence et le temps de vol deviennent du même ordre: 精0 力 精1 力 10-11 s quand D 力 10 -9 m2.s -1;– dans un liquide, la diffusion est aléatoire et on ne peut définir le temps de résidence: on définit un temps de vol 精1 = m D/k T (m est une masse effective, supérieure à la masse réelle de l’ion), temps au bout duquel la particule n’a plus souvenir d’où elle vient: 精1 力 10-12 s pour D 力 10-9 m2.s-1.2. Les matériaux superconducteurs ioniquesLes superconducteurs ioniques sont classés en trois groupes: les conducteurs cationiques, anioniques et protoniques.Les structures des superconducteurs ioniques sont diverses mais présentent des caractéristiques communes: un squelette rigide d’ions assez polarisables occupant des positions bien définies dans le réseau cristallin et ménageant entre eux des zones peu denses où diffusent les ions conducteurs. Le nombre de sites disponibles y est supérieur au nombre de sites occupés par ces ions. À basse température, les ions conducteurs sont généralement localisés dans des positions bien définies et le composé n’est pas superconducteur. Quand la température s’élève, un moment vient où l’énergie thermique k T et la barrière de potentiel EA sont du même ordre, et l’on observe une transition ordre-désordre avec établissement d’un état quasi liquide (fig. 1). Cependant, ce comportement n’est pas général. Le rôle de la non-stœchiométrie est particulièrement important (amortissement de la transition, formation de microdomaines, corrélations entre ions conducteurs). Les propriétés électriques dépendront essentiellement de paramètres géométriques (tailles des chemins de conduction et des ions conducteurs) et chimiques (nature de l’ion).Conducteurs cationiquesLes conducteurs cationiques peuvent être classés en trois familles selon le degré d’anisotropie de la conductivité: mono-, bi- ou tridimensionnelle.Le chef de file des composés tridimensionnels est l’iodure d’argent. À température ambiante, ce composé (AgI 廓) a une structure de type wurtzite (ZnS) et sa conductivité est assez faible. À 147 0C, une transition de phase conduit à une structure cubique centrée (AgI 見) qui est superconductrice (fig. 2 a). Les ions Ag+ sont délocalisés entre différents sites et forment un état quasi liquide. On notera que la conductivité du solide près du point de fusion est supérieure à celle du liquide. Les iodures mixtes d’argent MAg4I5, avec M = Rb+, K+ ou NH4+, sont superconducteurs à la température ordinaire; le composé au rubidium est particulièrement intéressant, car il est le seul stable vis-à-vis de l’humidité.Il est possible d’obtenir des superconducteurs ioniques sous forme vitreuse par mélange de l’iodure d’argent avec le phosphate d’argent (AgPO4) ou avec les oxydes d’argent (Ag2O) ou de molybdène (MoO3). Les sulfures donnent aussi des composés superconducteurs: à haute température (supérieure à 179 0C), Ag2S a une structure et des propriétés comparables à AgI 見.Parmi les autres conducteurs tridimensionnels, citons Na3Zr2Si2P12; le squelette est formé de l’association de tétraèdres P4 et Si4 et d’octaèdres Zr6; les ions conducteurs (Na+) sont distribués le long des canaux formés entre les tétraèdres et les octaèdres. Ce composé est un très bon conducteur et il présente l’intérêt de pouvoir être élaboré sous forme de céramique par frittage à basse température (1 200 0C) et de donner dans certaines conditions des verres et des vitrocéramiques, en particulier par le moyen des méthodes «sol-gel» développées à partir de l’hydrolyse-polycondensation d’alcoolates métalliques (M-O-R, où M = métal, O = oxygène, R = radical organique) appelées aussi polymérisation inorganique.La seconde famille est celle des composés de type alumines 廓 et 廓 . Elle comprend divers composés isomorphes: aluminates de sodium et de potassium, gallates de sodium et de potassium, ferrite de potassium; ce dernier composé est un conducteur mixte, ionique et électronique. La phase 廓, c’est-àdire 11 A23, (1 + x )M2O, où A = Al3+ , Ga3+, Fe3+ et M = Na+, K+, est non stœchiométrique (x varie de 0 à 1), tout comme la phase 廓 . Cette dernière est métastable mais peut être stabilisée par des impuretés comme Li2+ ou Mg2+ (par exemple: 5 Al23Mg1-x ONa2 (1-x )O).La structure de l’aluminate de sodium 廓 est hexagonale: la maille élémentaire se compose de deux blocs formés de couches d’ions oxygène en empilement compact, les ions Al3+ occupant les sites tétraédriques et octaédriques comme le spinelle MgAl24. Ces blocs sont séparés par un plan peu dense (fig. 2b): un ion oxygène forme avec deux ions aluminium un pont entre les blocs, et les cations conducteurs sont distribués dans différents sites de ce plan.L’aluminate de sodium 廓 a une structure comparable, mais la maille comporte trois blocs spinelle. Par réaction d’échange en sel fondu (nitrates) ou dans des acides, il est possible d’obtenir des composés isomorphes où les cations conducteurs sont: Na+, K+, Ag+, Tl+, Rb+, Li+, NH4+, H3+, Ga+, +, etc. La conductivité est fortement anisotrope: le rapport entre la conductivité parallèle au plan de conduction et la conductivité perpendiculaire à ce plan est supérieure à 1 000.Quand l’alumine 廓 est stœchiométrique (x = 0, M+ = Na+, Ag+), on observe une transition ordre-désordre avec apparition de la phase superconductrice, dans laquelle les ions conducteurs sont dans un état quasi liquide. Quand le composé est non stœchiométrique (x différent de 0), cette transition est amortie, voire masquée et déplacée vers les basses températures.La troisième famille est constituée par les conducteurs monodimensionnels. L’eucryptite 廓 (LiAlSiO4) en est un exemple. Elle a une structure hexagonale dérivée de la structure haute température du quartz 廓 (fig. 2c): les tétraèdres Si4 et Al4 sont associés en anneaux laissant entre eux des canaux où les ions lithium sont répartis de façon ordonnée à basse température (inférieure à 460 0C), et désordonnée à haute température. La conductivité mesurée sur monocristal est très anisotrope: le rapport 靖 size=1瑩/ 靖 size=1旅 à l’axe des canaux est supérieur à 100 000. Ce composé peut être obtenu sous forme de céramique, de vitrocéramique ou de verre. La conductivité du matériau fritté est très faible, car il y a peu de chance que les canaux communiquent au regard des joints de grains. Par contre, dans les vitrocéramiques ou le verre, la conductivité se rapproche de celle que l’on mesure parallèlement aux canaux dans un monocristal.Parmi les conducteurs monodimensionnels, citons encore les matériaux à structure bronze de tungstène, tels que Mx W3 formés d’un squelette d’octaèdres W6, Mx Mo3, Mx TiS2 ou M x V25 formés de chaînes de bipyramides V5 avec différents ions conducteurs (M = Na+, Li+, Ag+). Ces derniers matériaux sont des conducteurs mixtes (les ions de transition pouvant être dans différents états d’oxydation) et peuvent être utilisés comme matériaux d’électrodes.Les composés à conduction unidimensionnelle sont très sensibles à la présence d’impuretés qui bloquent les chemins de conduction, et, de ce fait, peu susceptibles d’applications.Verres et polymèresDu fait du désordre intrinsèque des verres, la conductivité ionique de ces matériaux est en général relativement élevée (de 10-7 à 10-4 行-1.m-1 à 25 0C), et un certain nombre d’entre eux présentent des propriétés de superconduction. Ce sont principalement des verres à base de mélange d’iodure d’argent (AgI) ou d’iodure de lithium (LiI) avec des formateurs de verre (AgPO3, Ag2S, GeS2, Li4P2S7...). En 1983, il a été montré que certains matériaux amorphes obtenus par polymérisation inorganique (par exemple NaZr1,8Si2P10,6, LiZr1,5Si2P212,5) étaient de très bons superconducteurs ioniques ( 靖 年 10-1 - 10-2 行-1.m-1 à 25 0C). De plus, par opposition aux matériaux précédents, ces compositions ne sont pas instables en présence de traces d’eau. Des polymères à base de polyéthylène oxide (face=F0019 漣 O 漣 CH2 漣 CH2), de polypropylène oxide (face=F0019 漣 O 漣 CH2 漣 CH), de polyépichro|CH3hydrine (face=F0019 漣 O 漣 CH2 漣 CH), de polyé|CH2Clthylène sulfide (S 漣 CH2 漣 CH2) sont utilisés comme réseaux hôtes de sels de métaux alcalins: Na(SO3C3), NaI, NaClO4, NaSCN, LiI, LiC3C2, LiS3C3... La mobilité des alcalins dans ces polymères est importante et des conductivités de 10-3 行-1.m-1 à 25 0C sont atteintes. Cependant, l’énergie d’activation, comme dans le cas des verres, est élevée (0,5 eV et plus). La mise en forme facile, bien que devant s’effectuer à l’abri des traces d’eau, procure des avantages spécifiques.Conducteurs anioniquesLa conduction est assurée par des ions oxygène, fluor, ou chlore. La structure de ces matériaux est soit de type fluorite (CaF2, Pb2, SrCl2, Ba2, Sr2, Ce2, Th2, U2, Zr2, Hg2), soit de type tysonite (LaF3, Ce3).Dans la structure fluorite, les cations forment un réseau cubique faces centrées et les anions occupent les sites tétraédriques entre les cations. Dans cette structure idéale, les sites octaédriques restent vides.Dans le cas des fluorures, on observe à une certaine température Tc (Tc 力 0,8 fusion) une transition de phase ordre-désordre liée à l’apparition de défauts de Frenkel: un anion quitte son site tétraédrique pour gagner le site octaédrique voisin; le taux d’anions en position interstitielle peut atteindre 30 p. 100 pour Ba2 et Pb2 et le désordre est tel que les ions fluor - forment un quasi-liquide.Dans le cas des oxydes stœchiométriques, la transition ordre-désordre avec apparition de l’état superconducteur n’a pas été observée, peut-être parce qu’elle se situerait à plus de 2 000 0C et que les expériences sont difficiles à cette température. Mais on peut obtenir une conduction rapide des ions oxygène par adjonction d’ions d’alcalino-terreux (Mg2+, Ca2+) ou de terres rares (La3+, Sc3+, Y3+) aux oxydes de zirconium, de chrome ou de thorium. La substitution d’ions tétravalents par des ions bivalents ou trivalents induit la formation de lacunes d’oxygène stabilisant la forme fluorite. Les meilleures conductivités sont obtenues avec des taux de dopage voisins de 10 p. 100 par des ions dont la charge et la taille sont aussi proches que possible de celles du cation prédominant.Conducteurs protoniquesQuelques bons conducteurs protoniques ont été découverts. La conduction protonique est un cas très particulier de la conductivité ionique. Différents mécanismes peuvent avoir lieu:– dans de rares cas (haute température), le proton existe et diffuse sous la forme H+;– quand le proton H+ est solvaté par une seule molécule d’eau (ion oxonium H3+) ou par une molécule d’ammoniac (ion ammonium NH4+), l’ion formé se comporte comme un ion classique et diffuse de la même façon que K+, dont la taille est comparable;– quand le proton est solvaté par plusieurs molécules d’eau, des espèces telles que H52+, H73+ apparaissent. Elles peuvent être décrites comme un ion H3+ lié à une ou deux molécules d’eau par une liaison hydrogène plus ou moins forte. La liaison peut s’inverser (saut de proton), puis la molécule d’eau et l’ion H3+ effectuent des rotations, de façon à reformer les liaisons hydrogène. La conduction s’effectue ainsi par une suite de sauts de protons (cf. tableau ci-dessus).Ce mécanisme, bien que couramment admis dans de nombreux composés (ioniques, biologiques), n’a pas encore été expérimentalement mis en évidence de façon claire.Longtemps, le meilleur conducteur protonique a été l’hydrate d’acide phosphotungstique H3(PW1240) 29 H2O, connu sous le nom de PWA, mais ce composé n’est pas stable au-dessus de 50 0C. Le composé de formule C6H122(H2S4)1,5 est stable jusqu’à 200 0C mais sa conductivité est assez faible (tabl. 2).Connu sous le nom de HUP, le phosphate d’uranyle hydraté H(UO2P4) 4H2O est un bon conducteur, stable jusqu’à 100 0C, et présente une énergie d’activation faible (0,3 eV). Ce composé a une structure lamellaire: une couche d’ions H3+ solvatés par des molécules d’eau est intercalée entre des couches compactes de groupements uranyle et phosphate (UO2 P4)- et la conductivité semble s’effectuer par saut de protons.Seuls les composés à structure alumine 廓 ou 廓 sont stables à plus haute température: les composés à l’ammonium jusqu’à 350 0C, les composés à l’oxonium jusqu’à 500 0C (alumine 廓 ) ou 700 0C (alumine 廓); leur conductivité est bonne (tabl. 2).3. ApplicationsLes applications des superconducteurs ioniques sont de plusieurs types; il convient de les différencier en deux grandes familles: les applications de puissance et celles où les puissances sont infimes. Les accumulateurs, les électrolyseurs, certaines piles à combustibles font partie de la première famille, tandis que les dispositifs «tout solides», les piles à longue durée de vie, les jauges spécifiques et capteurs, les afficheurs électrochromiques et les supercondensateurs ressortissent à la seconde. La plupart de ces derniers dispositifs peuvent être considérés comme des piles à concentration ou jauges: comme dans tout type de dispositifs électrochimiques, ils sont formés de l’association de régions à conductivité purement ionique – l’électrolyte – en contact avec des régions à conductivité électronique ou mixte – les électrodes. De multiples configurations sont possibles: dans le cas des capteurs, on mesure en circuit ouvert une différence de potentiel induite par une différence de concentration d’une espèce en contact avec les électrodes. En revanche, si un circuit extérieur impose un courant, deux cas sont possibles: ou bien les interfaces sont «bloquantes», les échanges ions ou électrons ne peuvent se faire, et on obtient un condensateur double couche ou supercondensateur; ou bien les interfaces sont perméables aux ions, et on a une batterie. Un cas particulier important est celui où l’électrode est «électrochrome», c’est-à-dire que l’injection d’ions induit un changement de coloration: on peut alors réaliser un afficheur.AccumulateursLes accumulateurs électriques présentent un certain nombre d’avantages par rapport aux autres systèmes de stockage d’énergie: temps de réponse et disponibilité propres à l’énergie électrique, absence de pollution de l’environnement et bonne rentabilité économique; les calculs faits en 1976 aux États-Unis avaient déjà montré que la filière «conversion du pétrole ou du charbon en énergie dans une centrale-accumulateurs-moteur électrique» était, pour la propulsion des véhicules automobiles, plus rentable que la filière traditionnelle du moteur à combustion interne. En 1985, une unité de 5 MWh était opérationnelle aux États-Unis (fig. 3) pour assurer les pointes de consommation d’une ville moyenne. L’accumulateur utilise le couple sodium/soufre avec comme électrolyte l’aluminate de sodium sous forme de céramique (tabl. 3). La forme Al23 廓 (C.G.E., General Electric) ou Al23 廓 (Ford) est utilisée.Les électrodes sont liquides à la température d’utilisation (300 0C): sodium et polysulfures de sodium. Le fait que les électrodes soient liquides évite l’empoisonnement de l’interface électrolyte/électrode et permet des densités de courant par unité de surface plus élevées. Les tubes sont mis en forme selon les techniques céramiques: extrusion ou pressage isostatique suivi d’un frittage entre 1 600 et 1 850 0C en atmosphère riche en oxyde de sodium. La conductivité d’une céramique est inférieure à celle d’un monocristal, du fait de la distribution aléatoire des cristaux, et l’énergie d’activation est légèrement plus élevée (effet des joints de grains). Les caractéristiques recherchées sont une faible résistivité (de 3 憐 10-2 à 5 憐 10-2 行m à 300 0C), une faible énergie d’activation (0,3 eV), une parfaite étanchéité (le rapport entre la densité théorique et la densité de la céramique est supérieur à 97 p. 100) et une microstructure contrôlée (grains de 10 à 100 猪m): de gros grains améliorent la conductivité (diminution des joints de grains) mais diminuent la résistance mécanique et la durée de vie de la cellule, qui doit être de plusieurs années.Dans les applications de puissance, la durée de vie est peut-être le critère principal du point de vue économique: 2 000 heures est le but visé par les accumulateurs Na/S. En fait, si certains dépassent 800 heures, beaucoup d’éléments fabriqués en petite série claquent au bout de 300 à 500 heures. Il faut souligner que la recherche de couple redox développant une tension élevée implique une dégradation chimique des matériaux. Lors des opérations de charges et de décharges d’un groupe de cellules Na/S (on les associe pour avoir une puissance installée importante), pour diverses raisons, une cellule peut être amenée à supporter des tensions de 10 V-20 V et plus. Il s’ensuit des injections d’électrons dans l’électrolyte, conduisant à la formation de défauts ponctuels et de microprécipité de sodium métallique, par exemple, dans les plans de conduction de l’alumine 廓 ou aux joints de grains de la céramique. La croissance de ces précipités entraîne la formation d’une dendrite court-circuitant l’électrolyte. La présence d’impuretés semble jouer un rôle important sur la cinétique de formation des défauts, l’accélérant ou la ralentissant.PilesSelon le type d’utilisation, on exige d’une pile des qualités très diverses: longévité, étanchéité, tension, stabilité du courant, vaste gamme de températures de fonctionnement, prix peu élevé, etc. Des piles étanches, car entièrement solides et à très longue durée de vie (une dizaine d’années), peuvent être réalisées à base d’iodure d’argent (Ag/AgI/ tantale) ou d’alumine 廓 (Na/11 Al23 1,3 Na2O/Br2): le sodium est sous forme d’amalgame et le brome est imprégné dans du graphite; cette pile fonctionne à la température ambiante et délivre une tension élevée (3,6 volts). Des piles utilisant l’iodure de lithium dispersé dans une poudre «inerte» ( 見 Al23) permettent de réaliser des piles pour pacemaker.Piles à combustibleUne pile à combustible est caractérisée par le fait que les réactifs (combustible, comburant) sont approvisionnés au fur et à mesure de leur consommation. Ces réactifs sont généralement gazeux (fig. 4).Les problèmes de pollution donnent un intérêt certain à la filière énergétique: électrolyse de l’eau-hydrogène-production d’électricité, tout comme à celle de la gazéification du charbon. Les piles à combustible haute température peuvent alors jouer un grand rôle. Les électrolytes utilisés sont ceux de la famille de la zircone. Ils doivent satisfaire à diverses conditions: conduction ionique maximale et conduction électronique négligeable; perméabilité de l’électrolyte aux gaz (air et hydrogène) le plus faible possible pendant toute la durée de vie de la cellule qui inclut de nombreux cycles thermiques.Le fait de fonctionner à haute température est un avantage car il évite l’emploi onéreux de métaux précieux (platine, palladium) comme catalyseur aux électrodes.Les oxydes de type fluorine dopés par des cations bi- ou trivalents sont les candidats possibles: CeO2, Th2, Zr2. Malheureusement, Ce2 se réduit en Ce2 size=1漣n en atmosphère de gaz combustible, ce qui provoque une conduction électronique. Th2 a une conductivité trop faible. La solution adoptée est la zircone stabilisée sous forme cubique, qui présente une bonne conductivité ionique et résiste mécaniquement aux cycles thermiques car elle ne présente pas d’anomalie de dilatation. Les ions dopants possibles sont le calcium, l’yttrium ou le scandium. L’yttrium est le plus employé, car il donne une bonne conductivité pour un coût acceptable.La fabrication de l’électrolyte pose de délicats problèmes de frittage: la membrane de zircone doit être à la fois très mince et étanche à l’hydrogène.La pile à combustible H22 opérant en atmosphère H2/H2vapeur a un voltage théorique de 1,1 V. Pour des applications commerciales, la densité de courant doit être de l’ordre de 1 ampère par centimètre carré. Comme l’électrolyte à la température d’utilisation a une résistivité de 10 size=1漣1 行m, la membrane doit avoir une épaisseur de l’ordre de 100 micromètres. Il faut donc pouvoir fabriquer une céramique de 100 à 500 micromètres d’épaisseur. Cela est réalisé par différentes entreprises (Brown-Boveri, C.G.E.), le frittage s’effectuant à haute température (de 1 600 à 1 800 0C).L’électrolyse de l’eau est une réaction symétrique de celle que l’on a utilisée dans les piles à combustibles H22: les électrolytes à conduction par ions 2 size=1漣 ou H+ doivent être utilisés comme électrolytes. Une membrane d’électrolyte (par exemple zircone dopée à l’yttrium) sépare un courant de vapeur d’eau à 800 0C d’un courant d’oxygène; de part et d’autre de l’électrolyte sont déposées des électrodes (Ni à la cathode, In23 ou Sn2 dopés à l’anode). Les réactions suivantes ont lieu respectivement à l’anode et à la cathode:
où 靖0 est le terme pré-exponentiel et E0 + Ef = Ea l’énergie d’activation. Le terme pré-exponentiel 靖0 dépend de la structure du matériau, tout comme l’énergie d’activation qui représente la somme de l’énergie nécessaire à la création du défaut, Ef , et de l’énergie nécessaire à sa diffusion, E0. Si l’on porte lg 靖T en fonction de 1/T, on obtient une droite dont la pente est proportionnelle à l’énergie d’activation. Pour les conducteurs ioniques (halogénures alcalins, oxydes, etc.), cette droite présente plusieurs ruptures de pente:– aux températures élevées, le comportement est dit intrinsèque; la concentration de défauts créés par l’agitation thermique est largement supérieure à celle des défauts dus aux impuretés; Eia représente la somme de l’énergie de formation et de celle de la migration du défaut;– quand la température diminue, un moment vient où la concentration en impuretés (ou dopant) fixe le nombre de porteurs de charges; ce domaine est dit extrinsèque et Ea ex représente seulement l’énergie de migration du défaut dû à l’impureté, toujours inférieure à Eia ;– à basse température, un domaine existe où la conductivité est réglée par des associations de défauts (formation de paires, par exemple); la pente est de nouveau forte car Ea est la somme des énergies d’association et de migration du défaut.Certains défauts ou impuretés peuvent provoquer une conductivité électronique.Un superconducteur ionique sera caractérisé par une conductivité ionique élevée et une énergie d’activation très faible, typiquement de 0,1 à 0,2 eV, ce qui représente moins de 10 p. 100 de l’énergie de formation d’un défaut ponctuel dans un cristal ionique et reflète les particularités structurales de cette classe de matériaux. Le nombre d’espèces conductrices est important et quasi indépendant de la température. Il existe de larges zones de défauts où, pour les ions conducteurs, le rapport entre sites disponibles et sites occupés est voisin de 1. La concentration de défauts est indépendante de la température.La figure 1 présente la variation de la conductivité en fonction de la température pour différents conducteurs ioniques; les valeurs de la conductivité et de l’énergie d’activation pour différents superconducteurs ioniques sont données dans le tableau 2.Liquide et superconducteur ioniqueUn champ électrique est statique ( 諸 = 0) ou alternatif; sa fréquence varie dans un très large domaine: depuis la lumière (infrarouge: 1013 Hz) jusqu’aux basses fréquences (50 Hz) en passant par les micro-ondes (109 Hz) et les ondes radio. La conductivité est fonction de la fréquence: 靖( 諸) = 諸 練 﨎0 練 﨎 ( 諸), où 﨎0 est la permitivité du vide et 﨎 ( 諸) la partie imaginaire de la constante diélectrique.Si la conductivité est à l’origine des applications des superconducteurs ioniques, elle est aussi un moyen d’étude puissant qui permet de relier les propriétés atomiques à celles que l’on peut observer macroscopiquement: quand la fréquence augmente, la distance du transport de matière observé diminue.En association avec d’autres méthodes comme la diffusion de neutrons, on a pu caractériser le mouvement des particules dans l’espace et dans le temps en déterminant les fonctions de corrélation et connaître le temps de résidence de l’espèce diffusive au fond de son puits de potentiel et son temps de vol entre deux puits. Selon les composés, trois grands types de mécanismes de diffusion existent:– dans un solide ionique, le temps de vol 精1 est court devant le temps de résidence 精0;– dans un superconducteur ionique (AgI 見, Na+ 廓Al23, Ag+ 廓Al23), le temps de résidence et le temps de vol deviennent du même ordre: 精0 力 精1 力 10-11 s quand D 力 10 -9 m2.s -1;– dans un liquide, la diffusion est aléatoire et on ne peut définir le temps de résidence: on définit un temps de vol 精1 = m D/k T (m est une masse effective, supérieure à la masse réelle de l’ion), temps au bout duquel la particule n’a plus souvenir d’où elle vient: 精1 力 10-12 s pour D 力 10-9 m2.s-1.2. Les matériaux superconducteurs ioniquesLes superconducteurs ioniques sont classés en trois groupes: les conducteurs cationiques, anioniques et protoniques.Les structures des superconducteurs ioniques sont diverses mais présentent des caractéristiques communes: un squelette rigide d’ions assez polarisables occupant des positions bien définies dans le réseau cristallin et ménageant entre eux des zones peu denses où diffusent les ions conducteurs. Le nombre de sites disponibles y est supérieur au nombre de sites occupés par ces ions. À basse température, les ions conducteurs sont généralement localisés dans des positions bien définies et le composé n’est pas superconducteur. Quand la température s’élève, un moment vient où l’énergie thermique k T et la barrière de potentiel EA sont du même ordre, et l’on observe une transition ordre-désordre avec établissement d’un état quasi liquide (fig. 1). Cependant, ce comportement n’est pas général. Le rôle de la non-stœchiométrie est particulièrement important (amortissement de la transition, formation de microdomaines, corrélations entre ions conducteurs). Les propriétés électriques dépendront essentiellement de paramètres géométriques (tailles des chemins de conduction et des ions conducteurs) et chimiques (nature de l’ion).Conducteurs cationiquesLes conducteurs cationiques peuvent être classés en trois familles selon le degré d’anisotropie de la conductivité: mono-, bi- ou tridimensionnelle.Le chef de file des composés tridimensionnels est l’iodure d’argent. À température ambiante, ce composé (AgI 廓) a une structure de type wurtzite (ZnS) et sa conductivité est assez faible. À 147 0C, une transition de phase conduit à une structure cubique centrée (AgI 見) qui est superconductrice (fig. 2 a). Les ions Ag+ sont délocalisés entre différents sites et forment un état quasi liquide. On notera que la conductivité du solide près du point de fusion est supérieure à celle du liquide. Les iodures mixtes d’argent MAg4I5, avec M = Rb+, K+ ou NH4+, sont superconducteurs à la température ordinaire; le composé au rubidium est particulièrement intéressant, car il est le seul stable vis-à-vis de l’humidité.Il est possible d’obtenir des superconducteurs ioniques sous forme vitreuse par mélange de l’iodure d’argent avec le phosphate d’argent (AgPO4) ou avec les oxydes d’argent (Ag2O) ou de molybdène (MoO3). Les sulfures donnent aussi des composés superconducteurs: à haute température (supérieure à 179 0C), Ag2S a une structure et des propriétés comparables à AgI 見.Parmi les autres conducteurs tridimensionnels, citons Na3Zr2Si2P12; le squelette est formé de l’association de tétraèdres P4 et Si4 et d’octaèdres Zr6; les ions conducteurs (Na+) sont distribués le long des canaux formés entre les tétraèdres et les octaèdres. Ce composé est un très bon conducteur et il présente l’intérêt de pouvoir être élaboré sous forme de céramique par frittage à basse température (1 200 0C) et de donner dans certaines conditions des verres et des vitrocéramiques, en particulier par le moyen des méthodes «sol-gel» développées à partir de l’hydrolyse-polycondensation d’alcoolates métalliques (M-O-R, où M = métal, O = oxygène, R = radical organique) appelées aussi polymérisation inorganique.La seconde famille est celle des composés de type alumines 廓 et 廓 . Elle comprend divers composés isomorphes: aluminates de sodium et de potassium, gallates de sodium et de potassium, ferrite de potassium; ce dernier composé est un conducteur mixte, ionique et électronique. La phase 廓, c’est-àdire 11 A23, (1 + x )M2O, où A = Al3+ , Ga3+, Fe3+ et M = Na+, K+, est non stœchiométrique (x varie de 0 à 1), tout comme la phase 廓 . Cette dernière est métastable mais peut être stabilisée par des impuretés comme Li2+ ou Mg2+ (par exemple: 5 Al23Mg1-x ONa2 (1-x )O).La structure de l’aluminate de sodium 廓 est hexagonale: la maille élémentaire se compose de deux blocs formés de couches d’ions oxygène en empilement compact, les ions Al3+ occupant les sites tétraédriques et octaédriques comme le spinelle MgAl24. Ces blocs sont séparés par un plan peu dense (fig. 2b): un ion oxygène forme avec deux ions aluminium un pont entre les blocs, et les cations conducteurs sont distribués dans différents sites de ce plan.L’aluminate de sodium 廓 a une structure comparable, mais la maille comporte trois blocs spinelle. Par réaction d’échange en sel fondu (nitrates) ou dans des acides, il est possible d’obtenir des composés isomorphes où les cations conducteurs sont: Na+, K+, Ag+, Tl+, Rb+, Li+, NH4+, H3+, Ga+, +, etc. La conductivité est fortement anisotrope: le rapport entre la conductivité parallèle au plan de conduction et la conductivité perpendiculaire à ce plan est supérieure à 1 000.Quand l’alumine 廓 est stœchiométrique (x = 0, M+ = Na+, Ag+), on observe une transition ordre-désordre avec apparition de la phase superconductrice, dans laquelle les ions conducteurs sont dans un état quasi liquide. Quand le composé est non stœchiométrique (x différent de 0), cette transition est amortie, voire masquée et déplacée vers les basses températures.La troisième famille est constituée par les conducteurs monodimensionnels. L’eucryptite 廓 (LiAlSiO4) en est un exemple. Elle a une structure hexagonale dérivée de la structure haute température du quartz 廓 (fig. 2c): les tétraèdres Si4 et Al4 sont associés en anneaux laissant entre eux des canaux où les ions lithium sont répartis de façon ordonnée à basse température (inférieure à 460 0C), et désordonnée à haute température. La conductivité mesurée sur monocristal est très anisotrope: le rapport 靖 size=1瑩/ 靖 size=1旅 à l’axe des canaux est supérieur à 100 000. Ce composé peut être obtenu sous forme de céramique, de vitrocéramique ou de verre. La conductivité du matériau fritté est très faible, car il y a peu de chance que les canaux communiquent au regard des joints de grains. Par contre, dans les vitrocéramiques ou le verre, la conductivité se rapproche de celle que l’on mesure parallèlement aux canaux dans un monocristal.Parmi les conducteurs monodimensionnels, citons encore les matériaux à structure bronze de tungstène, tels que Mx W3 formés d’un squelette d’octaèdres W6, Mx Mo3, Mx TiS2 ou M x V25 formés de chaînes de bipyramides V5 avec différents ions conducteurs (M = Na+, Li+, Ag+). Ces derniers matériaux sont des conducteurs mixtes (les ions de transition pouvant être dans différents états d’oxydation) et peuvent être utilisés comme matériaux d’électrodes.Les composés à conduction unidimensionnelle sont très sensibles à la présence d’impuretés qui bloquent les chemins de conduction, et, de ce fait, peu susceptibles d’applications.Verres et polymèresDu fait du désordre intrinsèque des verres, la conductivité ionique de ces matériaux est en général relativement élevée (de 10-7 à 10-4 行-1.m-1 à 25 0C), et un certain nombre d’entre eux présentent des propriétés de superconduction. Ce sont principalement des verres à base de mélange d’iodure d’argent (AgI) ou d’iodure de lithium (LiI) avec des formateurs de verre (AgPO3, Ag2S, GeS2, Li4P2S7...). En 1983, il a été montré que certains matériaux amorphes obtenus par polymérisation inorganique (par exemple NaZr1,8Si2P10,6, LiZr1,5Si2P212,5) étaient de très bons superconducteurs ioniques ( 靖 年 10-1 - 10-2 行-1.m-1 à 25 0C). De plus, par opposition aux matériaux précédents, ces compositions ne sont pas instables en présence de traces d’eau. Des polymères à base de polyéthylène oxide (face=F0019 漣 O 漣 CH2 漣 CH2), de polypropylène oxide (face=F0019 漣 O 漣 CH2 漣 CH), de polyépichro|CH3hydrine (face=F0019 漣 O 漣 CH2 漣 CH), de polyé|CH2Clthylène sulfide (S 漣 CH2 漣 CH2) sont utilisés comme réseaux hôtes de sels de métaux alcalins: Na(SO3C3), NaI, NaClO4, NaSCN, LiI, LiC3C2, LiS3C3... La mobilité des alcalins dans ces polymères est importante et des conductivités de 10-3 行-1.m-1 à 25 0C sont atteintes. Cependant, l’énergie d’activation, comme dans le cas des verres, est élevée (0,5 eV et plus). La mise en forme facile, bien que devant s’effectuer à l’abri des traces d’eau, procure des avantages spécifiques.Conducteurs anioniquesLa conduction est assurée par des ions oxygène, fluor, ou chlore. La structure de ces matériaux est soit de type fluorite (CaF2, Pb2, SrCl2, Ba2, Sr2, Ce2, Th2, U2, Zr2, Hg2), soit de type tysonite (LaF3, Ce3).Dans la structure fluorite, les cations forment un réseau cubique faces centrées et les anions occupent les sites tétraédriques entre les cations. Dans cette structure idéale, les sites octaédriques restent vides.Dans le cas des fluorures, on observe à une certaine température Tc (Tc 力 0,8 fusion) une transition de phase ordre-désordre liée à l’apparition de défauts de Frenkel: un anion quitte son site tétraédrique pour gagner le site octaédrique voisin; le taux d’anions en position interstitielle peut atteindre 30 p. 100 pour Ba2 et Pb2 et le désordre est tel que les ions fluor - forment un quasi-liquide.Dans le cas des oxydes stœchiométriques, la transition ordre-désordre avec apparition de l’état superconducteur n’a pas été observée, peut-être parce qu’elle se situerait à plus de 2 000 0C et que les expériences sont difficiles à cette température. Mais on peut obtenir une conduction rapide des ions oxygène par adjonction d’ions d’alcalino-terreux (Mg2+, Ca2+) ou de terres rares (La3+, Sc3+, Y3+) aux oxydes de zirconium, de chrome ou de thorium. La substitution d’ions tétravalents par des ions bivalents ou trivalents induit la formation de lacunes d’oxygène stabilisant la forme fluorite. Les meilleures conductivités sont obtenues avec des taux de dopage voisins de 10 p. 100 par des ions dont la charge et la taille sont aussi proches que possible de celles du cation prédominant.Conducteurs protoniquesQuelques bons conducteurs protoniques ont été découverts. La conduction protonique est un cas très particulier de la conductivité ionique. Différents mécanismes peuvent avoir lieu:– dans de rares cas (haute température), le proton existe et diffuse sous la forme H+;– quand le proton H+ est solvaté par une seule molécule d’eau (ion oxonium H3+) ou par une molécule d’ammoniac (ion ammonium NH4+), l’ion formé se comporte comme un ion classique et diffuse de la même façon que K+, dont la taille est comparable;– quand le proton est solvaté par plusieurs molécules d’eau, des espèces telles que H52+, H73+ apparaissent. Elles peuvent être décrites comme un ion H3+ lié à une ou deux molécules d’eau par une liaison hydrogène plus ou moins forte. La liaison peut s’inverser (saut de proton), puis la molécule d’eau et l’ion H3+ effectuent des rotations, de façon à reformer les liaisons hydrogène. La conduction s’effectue ainsi par une suite de sauts de protons (cf. tableau ci-dessus).Ce mécanisme, bien que couramment admis dans de nombreux composés (ioniques, biologiques), n’a pas encore été expérimentalement mis en évidence de façon claire.Longtemps, le meilleur conducteur protonique a été l’hydrate d’acide phosphotungstique H3(PW1240) 29 H2O, connu sous le nom de PWA, mais ce composé n’est pas stable au-dessus de 50 0C. Le composé de formule C6H122(H2S4)1,5 est stable jusqu’à 200 0C mais sa conductivité est assez faible (tabl. 2).Connu sous le nom de HUP, le phosphate d’uranyle hydraté H(UO2P4) 4H2O est un bon conducteur, stable jusqu’à 100 0C, et présente une énergie d’activation faible (0,3 eV). Ce composé a une structure lamellaire: une couche d’ions H3+ solvatés par des molécules d’eau est intercalée entre des couches compactes de groupements uranyle et phosphate (UO2 P4)- et la conductivité semble s’effectuer par saut de protons.Seuls les composés à structure alumine 廓 ou 廓 sont stables à plus haute température: les composés à l’ammonium jusqu’à 350 0C, les composés à l’oxonium jusqu’à 500 0C (alumine 廓 ) ou 700 0C (alumine 廓); leur conductivité est bonne (tabl. 2).3. ApplicationsLes applications des superconducteurs ioniques sont de plusieurs types; il convient de les différencier en deux grandes familles: les applications de puissance et celles où les puissances sont infimes. Les accumulateurs, les électrolyseurs, certaines piles à combustibles font partie de la première famille, tandis que les dispositifs «tout solides», les piles à longue durée de vie, les jauges spécifiques et capteurs, les afficheurs électrochromiques et les supercondensateurs ressortissent à la seconde. La plupart de ces derniers dispositifs peuvent être considérés comme des piles à concentration ou jauges: comme dans tout type de dispositifs électrochimiques, ils sont formés de l’association de régions à conductivité purement ionique – l’électrolyte – en contact avec des régions à conductivité électronique ou mixte – les électrodes. De multiples configurations sont possibles: dans le cas des capteurs, on mesure en circuit ouvert une différence de potentiel induite par une différence de concentration d’une espèce en contact avec les électrodes. En revanche, si un circuit extérieur impose un courant, deux cas sont possibles: ou bien les interfaces sont «bloquantes», les échanges ions ou électrons ne peuvent se faire, et on obtient un condensateur double couche ou supercondensateur; ou bien les interfaces sont perméables aux ions, et on a une batterie. Un cas particulier important est celui où l’électrode est «électrochrome», c’est-à-dire que l’injection d’ions induit un changement de coloration: on peut alors réaliser un afficheur.AccumulateursLes accumulateurs électriques présentent un certain nombre d’avantages par rapport aux autres systèmes de stockage d’énergie: temps de réponse et disponibilité propres à l’énergie électrique, absence de pollution de l’environnement et bonne rentabilité économique; les calculs faits en 1976 aux États-Unis avaient déjà montré que la filière «conversion du pétrole ou du charbon en énergie dans une centrale-accumulateurs-moteur électrique» était, pour la propulsion des véhicules automobiles, plus rentable que la filière traditionnelle du moteur à combustion interne. En 1985, une unité de 5 MWh était opérationnelle aux États-Unis (fig. 3) pour assurer les pointes de consommation d’une ville moyenne. L’accumulateur utilise le couple sodium/soufre avec comme électrolyte l’aluminate de sodium sous forme de céramique (tabl. 3). La forme Al23 廓 (C.G.E., General Electric) ou Al23 廓 (Ford) est utilisée.Les électrodes sont liquides à la température d’utilisation (300 0C): sodium et polysulfures de sodium. Le fait que les électrodes soient liquides évite l’empoisonnement de l’interface électrolyte/électrode et permet des densités de courant par unité de surface plus élevées. Les tubes sont mis en forme selon les techniques céramiques: extrusion ou pressage isostatique suivi d’un frittage entre 1 600 et 1 850 0C en atmosphère riche en oxyde de sodium. La conductivité d’une céramique est inférieure à celle d’un monocristal, du fait de la distribution aléatoire des cristaux, et l’énergie d’activation est légèrement plus élevée (effet des joints de grains). Les caractéristiques recherchées sont une faible résistivité (de 3 憐 10-2 à 5 憐 10-2 行m à 300 0C), une faible énergie d’activation (0,3 eV), une parfaite étanchéité (le rapport entre la densité théorique et la densité de la céramique est supérieur à 97 p. 100) et une microstructure contrôlée (grains de 10 à 100 猪m): de gros grains améliorent la conductivité (diminution des joints de grains) mais diminuent la résistance mécanique et la durée de vie de la cellule, qui doit être de plusieurs années.Dans les applications de puissance, la durée de vie est peut-être le critère principal du point de vue économique: 2 000 heures est le but visé par les accumulateurs Na/S. En fait, si certains dépassent 800 heures, beaucoup d’éléments fabriqués en petite série claquent au bout de 300 à 500 heures. Il faut souligner que la recherche de couple redox développant une tension élevée implique une dégradation chimique des matériaux. Lors des opérations de charges et de décharges d’un groupe de cellules Na/S (on les associe pour avoir une puissance installée importante), pour diverses raisons, une cellule peut être amenée à supporter des tensions de 10 V-20 V et plus. Il s’ensuit des injections d’électrons dans l’électrolyte, conduisant à la formation de défauts ponctuels et de microprécipité de sodium métallique, par exemple, dans les plans de conduction de l’alumine 廓 ou aux joints de grains de la céramique. La croissance de ces précipités entraîne la formation d’une dendrite court-circuitant l’électrolyte. La présence d’impuretés semble jouer un rôle important sur la cinétique de formation des défauts, l’accélérant ou la ralentissant.PilesSelon le type d’utilisation, on exige d’une pile des qualités très diverses: longévité, étanchéité, tension, stabilité du courant, vaste gamme de températures de fonctionnement, prix peu élevé, etc. Des piles étanches, car entièrement solides et à très longue durée de vie (une dizaine d’années), peuvent être réalisées à base d’iodure d’argent (Ag/AgI/ tantale) ou d’alumine 廓 (Na/11 Al23 1,3 Na2O/Br2): le sodium est sous forme d’amalgame et le brome est imprégné dans du graphite; cette pile fonctionne à la température ambiante et délivre une tension élevée (3,6 volts). Des piles utilisant l’iodure de lithium dispersé dans une poudre «inerte» ( 見 Al23) permettent de réaliser des piles pour pacemaker.Piles à combustibleUne pile à combustible est caractérisée par le fait que les réactifs (combustible, comburant) sont approvisionnés au fur et à mesure de leur consommation. Ces réactifs sont généralement gazeux (fig. 4).Les problèmes de pollution donnent un intérêt certain à la filière énergétique: électrolyse de l’eau-hydrogène-production d’électricité, tout comme à celle de la gazéification du charbon. Les piles à combustible haute température peuvent alors jouer un grand rôle. Les électrolytes utilisés sont ceux de la famille de la zircone. Ils doivent satisfaire à diverses conditions: conduction ionique maximale et conduction électronique négligeable; perméabilité de l’électrolyte aux gaz (air et hydrogène) le plus faible possible pendant toute la durée de vie de la cellule qui inclut de nombreux cycles thermiques.Le fait de fonctionner à haute température est un avantage car il évite l’emploi onéreux de métaux précieux (platine, palladium) comme catalyseur aux électrodes.Les oxydes de type fluorine dopés par des cations bi- ou trivalents sont les candidats possibles: CeO2, Th2, Zr2. Malheureusement, Ce2 se réduit en Ce2 size=1漣n en atmosphère de gaz combustible, ce qui provoque une conduction électronique. Th2 a une conductivité trop faible. La solution adoptée est la zircone stabilisée sous forme cubique, qui présente une bonne conductivité ionique et résiste mécaniquement aux cycles thermiques car elle ne présente pas d’anomalie de dilatation. Les ions dopants possibles sont le calcium, l’yttrium ou le scandium. L’yttrium est le plus employé, car il donne une bonne conductivité pour un coût acceptable.La fabrication de l’électrolyte pose de délicats problèmes de frittage: la membrane de zircone doit être à la fois très mince et étanche à l’hydrogène.La pile à combustible H22 opérant en atmosphère H2/H2vapeur a un voltage théorique de 1,1 V. Pour des applications commerciales, la densité de courant doit être de l’ordre de 1 ampère par centimètre carré. Comme l’électrolyte à la température d’utilisation a une résistivité de 10 size=1漣1 行m, la membrane doit avoir une épaisseur de l’ordre de 100 micromètres. Il faut donc pouvoir fabriquer une céramique de 100 à 500 micromètres d’épaisseur. Cela est réalisé par différentes entreprises (Brown-Boveri, C.G.E.), le frittage s’effectuant à haute température (de 1 600 à 1 800 0C).L’électrolyse de l’eau est une réaction symétrique de celle que l’on a utilisée dans les piles à combustibles H22: les électrolytes à conduction par ions 2 size=1漣 ou H+ doivent être utilisés comme électrolytes. Une membrane d’électrolyte (par exemple zircone dopée à l’yttrium) sépare un courant de vapeur d’eau à 800 0C d’un courant d’oxygène; de part et d’autre de l’électrolyte sont déposées des électrodes (Ni à la cathode, In23 ou Sn2 dopés à l’anode). Les réactions suivantes ont lieu respectivement à l’anode et à la cathode: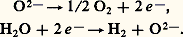 La vapeur d’eau est convertie en hydrogène, qui est utilisé comme vecteur chimique d’énergie. Le fonctionnement à température élevée avec un électrolyte solide permet de diminuer les surtensions d’électrodes et d’augmenter les densités de courants admissibles.Jauges et capteursLes superconducteurs ioniques permettent un dernier type d’applications importantes: les jauges de mesure de pressions partielles (O2, H2) ou d’activité spécifique (O2 size=1漣, H+, Na+, Ag+ ...). La première des jauges réalisée utilise la zircone pour mesurer les pressions partielles d’oxygène: on réalise une pile électrochimique où, de part et d’autre d’une membrane de zircone stabilisée, on établit deux pressions partielles p et p différentes. Une force électromotrice E apparaît:
La vapeur d’eau est convertie en hydrogène, qui est utilisé comme vecteur chimique d’énergie. Le fonctionnement à température élevée avec un électrolyte solide permet de diminuer les surtensions d’électrodes et d’augmenter les densités de courants admissibles.Jauges et capteursLes superconducteurs ioniques permettent un dernier type d’applications importantes: les jauges de mesure de pressions partielles (O2, H2) ou d’activité spécifique (O2 size=1漣, H+, Na+, Ag+ ...). La première des jauges réalisée utilise la zircone pour mesurer les pressions partielles d’oxygène: on réalise une pile électrochimique où, de part et d’autre d’une membrane de zircone stabilisée, on établit deux pressions partielles p et p différentes. Une force électromotrice E apparaît: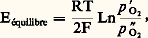 où F est la constante de Faraday, R la constante des gaz parfaits et T la température absolue.Cette cellule peut fonctionner à courant nul ou non. À courant nul, elle sert à mesurer des pressions d’oxygène. Si on connaît p , la mesure de E permet de calculer p ; cela est valable quelle que soit la façon dont la pression est appliquée: gaz contenant de l’oxygène, mélange de deux gaz donneurs et accepteurs d’oxygène (exemple: CO/C2, H2/H2O), solution d’oxygène dans un métal ou un sel fondu, couple métal-oxyde métallique (exemple: Ni + 1/2 2 曆 NiO). La mesure de la pression partielle est utilisée pour la régulation de la combustion des moteurs à explosion. La jauge est formée de couches minces de zircone stabilisée: plus l’épaisseur est faible, plus la résistance diminue, et les temps de réponse de la jauge sont d’autant plus courts.On mesure des pressions partielles d’hydrogène ou l’activité des ions H+ en utilisant l’alumine 廓 à conduction protonique comme électrolyte. L’alumine 廓 à Na+, Ag+ permet de mesurer la concentration de sodium ou d’argent dans des bains fondus d’acier ou dans des sels fondus.La pile peut fonctionner à courant non nul: si on lui impose une tension E, c’est une pompe à oxygène (ou hydrogène, sodium, argent, etc.).Si p et p sont différents et si la cellule est reliée à une résistance de charge, il y aura production de courant: en maintenant constamment p et p différents, on a une pile à combustible.SupercondensateursLes supercondensateurs utilisent la «double couche» d’accumulation d’ions et d’électrons à une interface bloquante. On obtient ainsi une capacité par unité de surface d’environ 10 à 50 猪F/cm2.L’utilisation d’électrode à grande surface spécifique comme le carbone (charbon actif à 1 500 m2/g) conduit à des condensateurs pour stockage d’énergie de quelques farads par centimètre cube, ce qui est de dix à cent fois plus petit que les meilleurs condensateurs électrolytiques (aluminium, tantale). La tension de travail doit rester cependant du même ordre de grandeur que la fenêtre électrochimique (de 0,5 à 3 V), bien que, pour des raisons de cinétique, la décomposition ne se produise pas dans le cas des électrolytes solides.La dernière application possible des superconducteurs ioniques – ou mixtes – est celle de résistors de fours fonctionnant en atmosphère oxydante jusqu’à 2 300 0C (ZrO2).
où F est la constante de Faraday, R la constante des gaz parfaits et T la température absolue.Cette cellule peut fonctionner à courant nul ou non. À courant nul, elle sert à mesurer des pressions d’oxygène. Si on connaît p , la mesure de E permet de calculer p ; cela est valable quelle que soit la façon dont la pression est appliquée: gaz contenant de l’oxygène, mélange de deux gaz donneurs et accepteurs d’oxygène (exemple: CO/C2, H2/H2O), solution d’oxygène dans un métal ou un sel fondu, couple métal-oxyde métallique (exemple: Ni + 1/2 2 曆 NiO). La mesure de la pression partielle est utilisée pour la régulation de la combustion des moteurs à explosion. La jauge est formée de couches minces de zircone stabilisée: plus l’épaisseur est faible, plus la résistance diminue, et les temps de réponse de la jauge sont d’autant plus courts.On mesure des pressions partielles d’hydrogène ou l’activité des ions H+ en utilisant l’alumine 廓 à conduction protonique comme électrolyte. L’alumine 廓 à Na+, Ag+ permet de mesurer la concentration de sodium ou d’argent dans des bains fondus d’acier ou dans des sels fondus.La pile peut fonctionner à courant non nul: si on lui impose une tension E, c’est une pompe à oxygène (ou hydrogène, sodium, argent, etc.).Si p et p sont différents et si la cellule est reliée à une résistance de charge, il y aura production de courant: en maintenant constamment p et p différents, on a une pile à combustible.SupercondensateursLes supercondensateurs utilisent la «double couche» d’accumulation d’ions et d’électrons à une interface bloquante. On obtient ainsi une capacité par unité de surface d’environ 10 à 50 猪F/cm2.L’utilisation d’électrode à grande surface spécifique comme le carbone (charbon actif à 1 500 m2/g) conduit à des condensateurs pour stockage d’énergie de quelques farads par centimètre cube, ce qui est de dix à cent fois plus petit que les meilleurs condensateurs électrolytiques (aluminium, tantale). La tension de travail doit rester cependant du même ordre de grandeur que la fenêtre électrochimique (de 0,5 à 3 V), bien que, pour des raisons de cinétique, la décomposition ne se produise pas dans le cas des électrolytes solides.La dernière application possible des superconducteurs ioniques – ou mixtes – est celle de résistors de fours fonctionnant en atmosphère oxydante jusqu’à 2 300 0C (ZrO2).
Encyclopédie Universelle. 2012.
